[急求高中化学计算摩尔浓度的计算公式越全面越好]1)物质的量浓度就是单位体积内物质的摩尔数,公式:c=n/v,单位:mol/L (2)气体摩尔体积就是1摩尔气体在标准状况下的体积(标准状况的定义:温度为0摄氏度,一个标准大气压)。所有气体在标...+阅读
如果显示不全,留言给我,留下邮箱,我把文件发给你,祝你进步! 一. 书写要遵循的原则: 无论原电池还是电解池,其电极反应均是氧化还原反应,因此电极方程式的书写要遵循质量守恒、电子守恒及电荷守恒,两电极反应方程式相加得电池总反应方程式;已知一电极反应方程式,则电池总反应方程式减去该电极反应方程式,即得另一电极反应方程式。 二. 电化学反应方程式的书写方法 1. 正确判定两个电极和电极反应物,电极反应式要符合守恒规律。 例1. 电解原理在化学中有广泛应用。下图表示一个电解池,a为电解液;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则 ①电解池中X极上的电极反应式为__________________,在X极附近观察到的现象是_____________________; ②Y电极上的电极反应式为______________________,检验该电极反应产物的方法是________________________。
(2)如果用电解方法精炼粗铜,电解液a选用 溶液,则 ①X电极的材料是______________,电极反应式为_____________; ②Y电极的材料是______________,电极反应式为_____________。 (说明:杂质发生的电极反应不必写出) 图:负极(左)正极(右),X连负极,Y连正极 分析:本题要求用电解原理设计两个电解池,a为电解液;X、Y是两块电极板,通过导线与直流电源相连。对
(1):阳极 的放电能力比 强,生成 ;阴极X极,阳离子 的放电能力比 强,生成 ;溶液中溶质为 ,使酚酞变红。 对
(2):为电解精炼池,阳极Y极为粗铜溶解极, 放电;阴极X极为 析出极, 放电。 答案:
(1)① 放出气体,溶液变红 ② 把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色
(2)①纯铜 ②粗铜 2. 正确处理电化学反应中的非氧化还原反应。 例2. 宇宙飞船中的氢氧燃料电池,其电池反应为: 。试写出电解质溶液为盐酸或KOH溶液的电极反应方程式。 分析: 和 之间的氧化还原反应为: 分解: ; 在酸性溶液(如盐酸)中, 稳定存在, 必然与 结合为水(非氧化还原反应);在碱性溶液(如KOH溶液)中, 必然与 结合为水, 必然与 结合为 (非氧化还原反应)。 答案:盐酸作电解质溶液时 负极反应: ; 正极反应: KOH溶液作电解质溶液时 负极反应: ; 正极反应: 3. 在电解池中,溶液中离子浓度的改变有时可导致离子的放电顺序改变。 例3. 工业上用 和KOH为原料制取高锰酸钾,主要生产过程分两步进行;第一步,将 和KOH固体粉碎,混合均匀,在空气中加热熔化,并连续搅拌,制取 ;第二步,将 的浓溶液进行电解,制取 。
(1)制取 的 是这一氧化还原反应的___________剂(填“氧化”或“还原”),“连续搅拌”的作用是________________。
(2)电解 的浓溶液时,两极发生的电极方程式为:阴极是______________,阳极是_______________,电解总的方程式为_____________________。 解析:
(2) 的浓溶液中,在阴极,阳离子 放电能力大于 ;在阳极,常规应该是 放电,因 的浓度远大于 而且题目中已提示制取高锰酸钾,所以 放电,而 不放电。则答案为:
(1)还原 连续搅拌,使 在KOH存在条件下与 充分接触,发生氧化还原反应
(2) 再如电解 溶液时,酸性溶液中 放电,当 的浓度很小时,则 放电。如镀锌操作中,用粗锌作阳极,镀件作阴极,饱和 溶液作电解液,则 放电。 4. 可充电池是联系原电池和电解池的桥梁,它也是电化学部分的重要考点。 在书写可充电池电极反应式时,首先要明确电池和电极,放电为原电池,充电为电解池;原电池的负极与电解池的阳极发生氧化反应,对应元素化合价升高;原电池的正极与电解池的阴极发生还原反应,对应元素化合价降低。 例4. 已知,铅蓄电池总的化学方程式为: 镍镉碱性充电电池在放电时,正极反应: 负极反应: 铜蓄电池使用(放电)一段时间后,其内阻明显增大,电压却几乎不变;镍镉碱性充电电池使用(放电)到后期,当电压明显下降时,其内阻却几乎不变,回答下列问题:
(1)铅蓄电池放电时的负极反应式为:_____________________;充电时的阳极反应式为_________________________。
(2)镍镉电池充电时总反应方程式为:____________________。
(3)上述两种电池使用一段时间后,一个内阻明显增大,另一个内阻几乎不变,其原因是__________________________。 解析:
(1)放电为原电池,充电为电解池,负极和阳极失去电子,正极和阴极则得到电子,故Pb为负极, 为阳极,电极反应式分别为: 负极: 阳极:
(2)镍镉碱性充电电池在放电时总反应方程式为两电极反应相加,充电则为放电的逆反应:
(3)内阻与电极材料及电解质浓度有关,铅蓄电池在放电时除消耗电极材料外,同时还消耗电解质溶液中的溶质(硫酸),使电解质溶液中自由移动的离子浓度减小,导电能力降低(内阻增大),而镍镉电池在使用过程中,只消耗水,电解质溶液中自由移动的离子浓度没减小(略增大),所以导电能力几乎不变。
以下为关联文档:
高中化学计算公式大全高中化学 有关物质的量(mol)的计算公式 (1)物质的量(mol)(2)物质的量(mol)(3)气体物质的量(mol)(4)溶质的物质的量(mol)=物质的量浓度(mol/L)*溶液体积(L)2. 有关溶液的计算公式 (1)基本公式①...
谁能帮我整理下高中化学计算公式1、氧化性: F2+H2===2HF F2+Xe(过量)===XeF2 2F2(过量)+Xe===XeF4 nF2+2M===2MFn(表示大部分金属) 2F2+2H2O===4HF+O2 2F2+2NaOH===2NaF+OF2+H2O F2+2NaCl===2NaF+Cl2 F2+2NaBr===2...
高中化学的重点难点疑点化学是一门很有魅力的学科。但由于高中化学具有“繁,难,乱”的特点,所以不少同学对学习高中化学感到困难。那么如何才能学好高中化学呢? 一、 认真听课,做好笔记。 好的笔记是教...
高中化学重点难点氧化还原反应是核心,从高一到高三课本一直在逐步阐述他的原理,计算及应用.因为高中化学研究的是反映的本质:电子的得失或偏离.所以这是首要核心,其中包括氧化还原反映,离子反应,热...
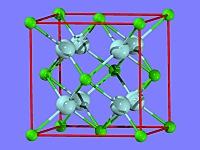
高中化学晶胞体积计算问题 图中外框顶点和面心的是Ca2+(8*1/8+6*1/2=4),中间的大球为F-(8*1=8),此结构中含4个CaF2。 最近的阳离子之核间距为d,应为面心到顶角的距离。则此立方体边长应为(2d)^1/2 密度(40+...
高中化学必修1所有知识点物质的量、氧化还原反应、金属及其氧化物、非金属及其氧化物 一、 研究物质性质的方法和程序 1. 基本方法:观察法、实验法、分类法、比较法 2. 基本程序: 3.:用比较的方法对观...
高中化学必修一的重要知识点1水:常温下是液态;2.稀有气体:单原子分子;3.SO3:常温下是液态或固态;4. NO2:存在与N2O4的平衡;5. 气体的体积:注意标准状况下才能用22 4 L。6.不是气体的有机物不需要标准状况的条件,...
高中化学竞赛有关流程全国高中学生化学竞赛分为两个阶段:全国高中学生化学竞赛(省级赛区),简称初赛;和“全国高中学生化学竞赛”简称决赛。 1、初赛在每年9月中旬举行,笔试(3小时),全国统一时间在各省市自...
一道电化学的试题高手帮帮忙(1) X是负极 因Ag在Cu电极上沉积 (2) 0.025mol/L 沉积的Ag有2.16/108=0.02mol 转移电子总数0.02mol B中收集到的气体0.224/22.4=0.01mol 电子流过B的阳极时生成0.02/4=0.005...